2019-05-10
Kommissionens remissvar SOU 2018:89 – Tydligare ansvar och regler för läkemedel
Med anledning av remittering av SOU 2018:89 inkommer Kommissionen för Innovativa Särläkemedel (Kommissionen) härmed med sitt remissvar.
Om Kommissionen
Kommissionen för Innovativa Särläkemedel är ett initiativ av åtta forskningsintensiva läkemedelsföretag: Alexion, Amicus, BioMarin, Chiesi, Kyowa Kirin, Sanofi Genzyme, Takeda samt Vertex.
Kommissionen efterlyser förbättringar inom vården av personer med mycket sällsynta och svåra sjukdomstillstånd. Detta inkluderar diagnostisering, sjukdomsbehandling och tillgång till innovativa läkemedel. Patienter med allvarliga och ovanliga sjukdomar väntar ofta i flera år på en korrekt diagnos och därefter väntar ofta en kamp för att få vårdresurser. Målsättningen för Kommissionen är att lyfta fram förslag som kan bidra till att förbättra den svenska vårdmodellen för personer med sällsynta sjukdomar.
Utredningen lyfter fram att tillgången till läkemedel för patienter med sällsynta diagnoser är oförutsägbar och även kan variera över landet. Vi anser dock att utredningens fokus på patienterna i denna utsatta grupp är otillräckligt.
Vi vill betona att de problem vi sett hittills med utvärdering, prisförhandlingar och införande kommer att accelerera, eftersom forskning och utveckling kommer att ge allt fler smala, skräddarsydda och effektiva (med därmed också kostsamma) särläkemedel framåt. Dilemmat för vården och patienter med sällsynta diagnoser kommer alltså att tillta.
Kommissionens fokus i utredningen
För Kommissionen tangerade utredningens direktiv våra medlemmars kärnfrågor (forskande läkemedelsbolag), men även våra målgrupper – patienter med sällsynta diagnoser. Framför allt har vi läst slutbetänkandet med följande utgångspunkter och ambitioner:
- god tillgång till befintliga och nya effektiva läkemedel till en rimlig kostnad,
- en jämlik och patientcentrerad vård,
- tydlig ansvarsfördelning mellan stat och landsting,
- förutsägbara processer för berörda aktörer,
- att eftersträva goda förutsättningar för forskning och innovation till nytta för patienten
Utredningen slår fast att tillgången på läkemedel i Sverige generellt är godtagbar i jämförelse med andra länder. Ett undantag som nämns i utredningen är läkemedel mot sällsynta tillstånd, där man skriver att det delvis brister i tillgången på dessa (s 404). Kommissionen välkomnar det fokus som utredningen lagt vid att kartlägga problemet med bristande, sen och ofta ojämlik tillgång till särläkemedel för svenska patienter med sällsynta diagnoser. I utredningens direktiv anges två mål vad gäller läkemedel för sällsynta tillstånd:
- Hitta finansierings- och prissättningslösningar som möjliggör god tillgång och användning av läkemedel även vid sällsynta tillstånd.
- Det är viktigt att kostnaderna för sådana läkemedel hålls på rimlig nivå.
Sammanfattande kommentar
Kommissionen ställer sig överlag positiv till utredarnas resonemang och förslag kring subvention, betalningsvilja, prissättning och introduktion av läkemedel för sällsynta sjukdomar.
Kommissionen för innovativa särläkemedel arbetar för tydligare besluts- och budgetprocesser baserade på allas lika värde, behovssolidaritet och jämlikhet i vården. Det är därför av största vikt att nya lagförslag utformas så att de beaktar och främjar ett system som tillgodoser en god försörjning till sällsynta sjukdomar, en patientgrupp som ofta hamnar mellan stolarna i ett komplext och svåröverskådligt system.
Kommissionen anser att det finns tydliga indikationer på att utredningen är inne på rätt spår för att finna lösningar på den ojämlikhet och osäkerhet som råder både för läkemedelsbolagen och patienterna på området. Samtidigt anser Kommissionen att det finns flera åtgärder som skulle skapa effektivare lösningar för samtliga involverade parter.
Förslagen som berör sällsynta diagnoser och särläkemedel
Kommissionen för innovativa särläkemedel välkomnar – och kommenterar – följande av de förslag som presenteras i utredningen.
1. En ny myndighet, Läkemedelsrådet, inrättas.
Kommissionen tillstyrker förslaget om att en ny myndighet inrättas för behovsprövning av läkemedelsfrågor. Att inrätta en ny myndighet, som skulle kunna ersätta NT-rådet, har flera viktiga poänger för våra forskande läkemedelsföretag:
- I dag är det ingen rättighet att få ett nytt preparat bedömt och prövat och det finns exempel på nya, innovativa läkemedel som inte tagits upp för prövning av NT-rådet med hänvisning till att patientgruppen är för liten. För landstingen är det liktydigt med att NT inte rekommenderar upptag och användning
- Ett myndighetsbeslut ökar rättssäkerheten. En negativ rekommendation från NT-rådet är inte ett myndighetsbeslut och därmed inte möjligt att överklaga. Ett myndighetsbeslut innebär att transparensen ökar
- Vi anser att Läkemedelsrådet bör ha några centrala egenskaper, oavsett hur den är sammansatt (statlig eller inter-regional). Det bör finnas en obligatorisk rätt till prövning och prisförhandling (tex trepartsförhandling). Dessutom bör Läkemedelsrådets rekommendationer vara liktydiga med myndighetsbeslut – transparenta och överklagningsbara
- Vi ser också gärna en förstärkt rätt till ny förhandling när det finns nya data kring en terapi. Eftersom patientgrupperna är små och underlagen därmed svagare än för stora patientgrupper sker ofta stegvisa framsteg i behandlingseffekt och -data
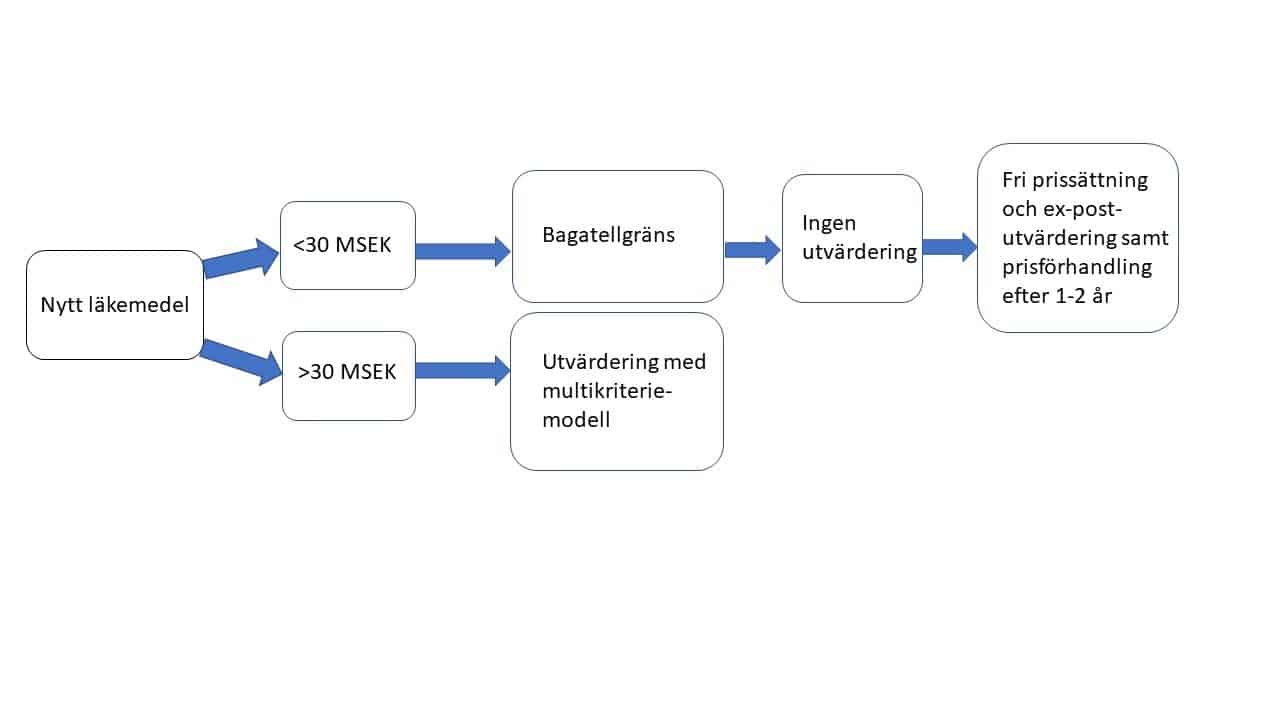
- För att minska byråkrati och snabba på införande av nya, effektiva läkemedel för mycket små grupper kunde myndigheten tillämpa en bagatellgräns, där EU-godkända läkemedel med en mycket liten
patientgrupp upp till en viss budgetpåverkan inte behöver gå igenom samma process som bredare läkemedel (se modell nedan)
2. Solidarisk finansiering vid sällsynta tillstånd
Kommissionen tillstyrker förslaget om att en solidarisk pott om 200 MSEK per år öronmärks för finansiering av läkemedel vid sällsynta tillstånd. Kommissionen är positiv till att Läkemedelsrådet får i uppgift att besluta vilka läkemedel som ska inkluderas eller exkluderas, vilket leder till ökad tydlighet. Den geografiska snedfördelningen kommer även att utjämnas, vilket är till fördel för ovanligt kostsamma läkemedel eller behandlingar.
3. Finansiering av nya effektiva läkemedel
Kommissionen tillstyrker förslagen om att inrätta ett statligt bidrag på 500 MSEK för nya, innovativa och särskilt effektiva läkemedel. Samtidigt finns det tydliga följdfrågor som inte behandlas av utredningen, då det inte framkommer vilka läkemedel som kan omfattas samt att summan är förhållandevis blygsam i jämförelse mot hela förmånskostnaden som ligger på cirka 30 miljarder SEK. För att denna modell ska vara meningsfull bör den också ligga utanför ram och ha tydliga kriterier för vilka typer av läkemedel som kan komma ifråga. En modell som skulle kunna tillämpas är den multi-kriterie-modell som vi föreslår nedan.
4. Behovet av en ny modell för betalningsvilja
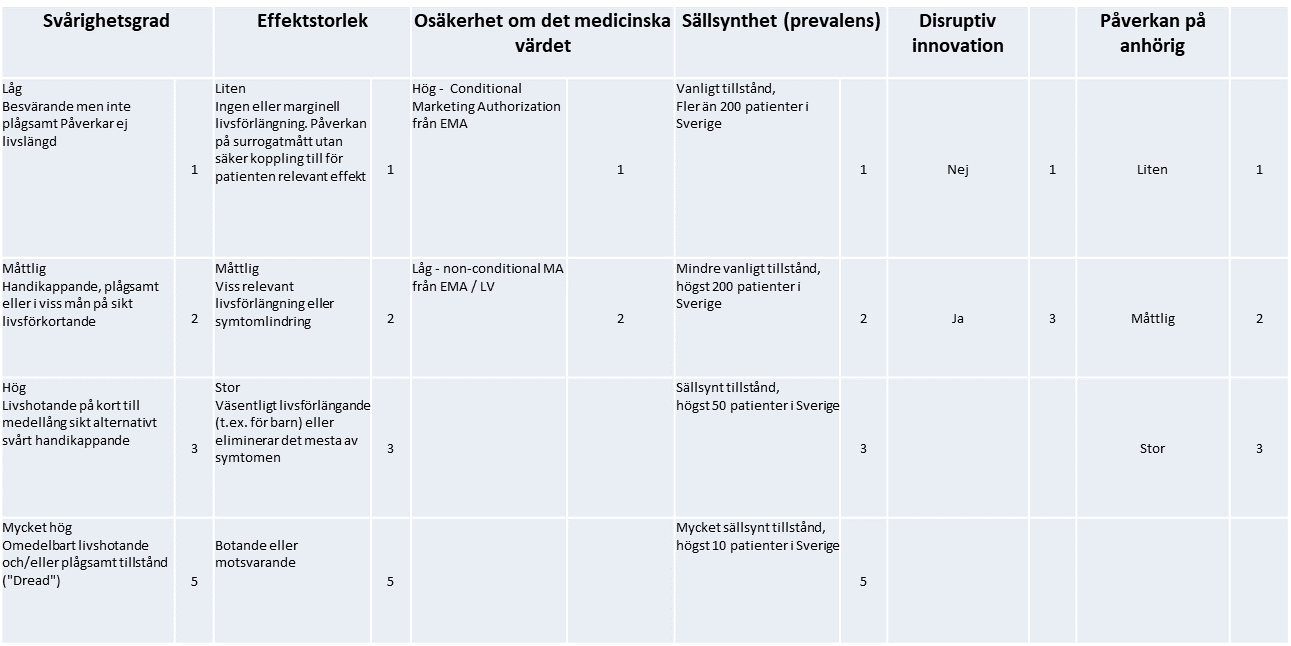
Utredningen skriver att det finns skäl för samhället att i vissa specialfall uttrycka en högre betalningsvilja för effektiva läkemedel mot mycket sällsynta tillstånd, men generellt bör man inta en restriktiv hållning gentemot omotiverat höga priser i förhållande till den hälsoeffekt som uppnås. Kommissionen tillstyrker detta, men menar att det fortfarande är oklart i vilka specialfall en högre betalningsvilja renderas. För att öka transparensen kring denna fråga föreslår Kommissionen en kvantitativ multikriteriemodell (se bilaga). Denna modell bygger på den modell som redan idag används av NT-rådet, men den har utökats med fler dimensioner som är viktiga för betalningsviljan och den är kvantitativ. Modellen medger en högre betalningsvilja för verklig innovation och lägre betalningsvilja för så kallade me-too-produkter.
5. Tillsätt en ny utredning för att se över den etiska plattformen
Trots omfattande arbete och analys inom ramen för utredningen finns det fortfarande frågor kring hur betalningsviljan ser ut och hur man ska anpassa sig till prioriteringsplattformen. Dagens utgångspunkt för betalningsvilja för ett vunnet QALY är gammal och har i princip använts sedan LFN bildades år 2001. Studier från IHE (Institutet för Hälsoekonomi) indikerar att betalningsviljan för ett vunnet QALY borde justeras upp med en faktor på ca 2-3.
Kommissionen föreslår att regeringen skyndsamt beslutar om ett tilläggsdirektiv och utreder frågor som rör hur den etiska plattformens principer om människovärde, behov, solidaritet och kostnadseffektivitet ska rangordnas.
Viktiga frågor att se över vad gäller den etiska plattformen är tex om de tre principerna (människovärde, behov- och solidaritet och kostnadseffektivitet) skall rangordnas efter betydelse. Man bör också i enlighet med vad som nämndes ovan se över vad betalningsviljan för ett QALY ska vara. Man bör bestämma vilket perspektiv som ska gälla i kostnadseffektanalyser (samhälleligt eller hälso- och sjukvårdsperspektiv). Man bör därtill se över vilka dimensioner (förutom svårighetsgrad) som är viktiga för betalningsviljan (tex sällsynthet, osäkerhet).
Gällande den sista punkten ovan, så anser kommissionen att en multikriteriemodell för utvärdering av kostnadseffektivitet ska införas där betalningsviljan eller hälsovinst kan tillåtas variera mellan olika sjukdomstillstånd och behandlingar. Ett förslag på en sådan modell presenteras nedan (se bilaga). Enligt Kommissionen bör bland annat en sjukdoms grad av sällsynthet samt påverkan på anhöriga tillmätas betydelse för betalningsviljan.
Kommissionens kompletterande förslag inför regeringens proposition
Bakgrund – basfakta om särläkemedel
- Vad är definitionen av sällsynta diagnoser som träffas av särläkemedel?
– 5 / 10 000 personer (EU förordningen 141/2000)
– 1 / 10 000 personer (SOU 2012:75) - Hög kostnad kan drabba enskild klinik – men totalt sett utgör särläkemedel en liten kostnadsandel (ca 3 procent av totala årliga läkemedelskostnader enligt SOU 2012:75) i termer av budgetpåverkan
- Utmaning för landstingen att bygga kunskap kring vården av sällsynta diagnoser utifrån mycket små patientgrupper – stort behov av nationell samordning av kompetens
Kommissionens förslag på utveckling av dagens modell för betalningsvilja – en multikriteriemodell
- Först behöver man tydligt definiera och inkludera de dimensioner som är viktigast för samhällets betalningsvilja för nya terapier
- Därefter behövs en kvantifiering av graderna/nivåerna i de olika dimensionerna och en totalpoäng kan därefter beräknas
- Slutligen behöver betalningsviljan anpassas till den möjliga totalpoängen
Kommissionens förslag på en kvantitativ multikriteriemodell: Steg 1 – Definiera dimensioner och poäng per nivå
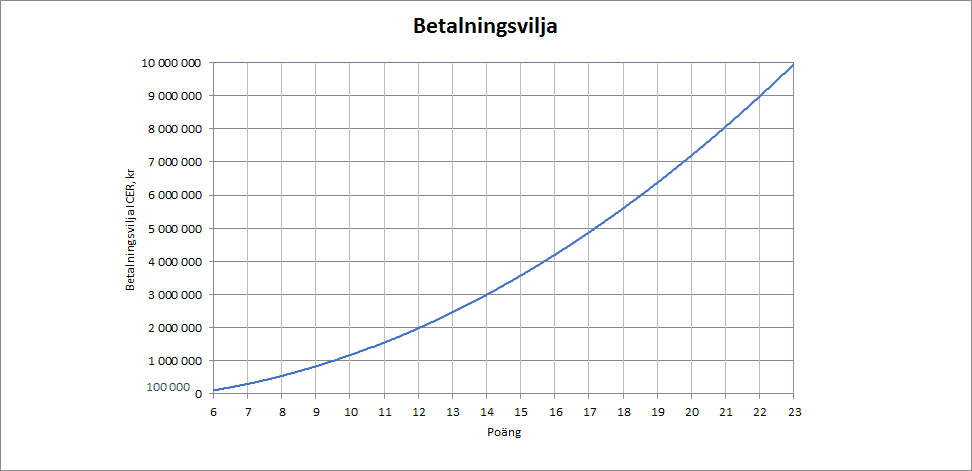
Steg 2: Bestäm max- och minvärde på betalningsvilja per vunnet QALY och anpassa kurva mellan max- och minvärde
Alternativ modell med tillämpning av bagatellgräns
Med sådan ansats kan man försäkra sig dels att patienter får tillgång till läkemedel som har liten budgetpåverkan, dels säkerställer den att utvärderingsresurser används på områden med störst förväntad impact. Man kan t.ex. tillämpa en bagatellgräns på smala, EMA-godkända läkemedel med total årlig budgetpåverkan understigande 30 MSEK/ år. Ingen förhandling eller prövning, direkt införande med ex-post utvärdering och omförhandling av pris efter 1-2 år.